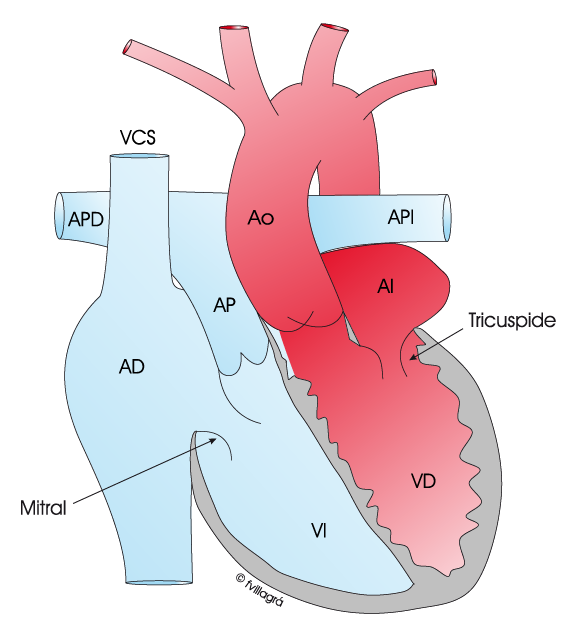
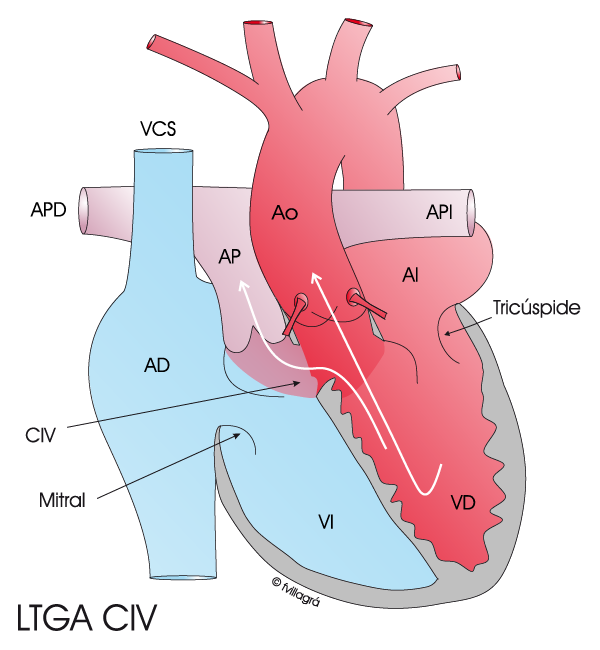
En la transposición corregida de grandes vasos (L-TGA) se mantiene la total normalidad de los flujos sanguíneos (la sangre (azul) no oxigenada va al pulmón (P) y la (roja) oxigenada, a todo el cuerpo (C), pero el ventrículo situado a la izquierda tiene un miocardio, una estructura muscular y una válvula auriculoventricular (válvula tricúspide) propias del ventrículo derecho; en realidad es el ventrículo anatómicamente derecho (VD) que por error está haciendo las veces del izquierdo y envía sangre a la aorta y todo el cuerpo. El ventrículo situado a la derecha tiene un miocardio, una estructura muscular y una válvula auriculoventricular (válvula mitral) propias del ventrículo izquierdo; en realidad es el ventrículo anatómicamente izquierdo (VI) que por error está haciendo las veces del derecho y envía sangre al pulmón a través de la arteria pulmonar. Los flujos sanguíneos son normales pero los ventrículos están cambiados por error.
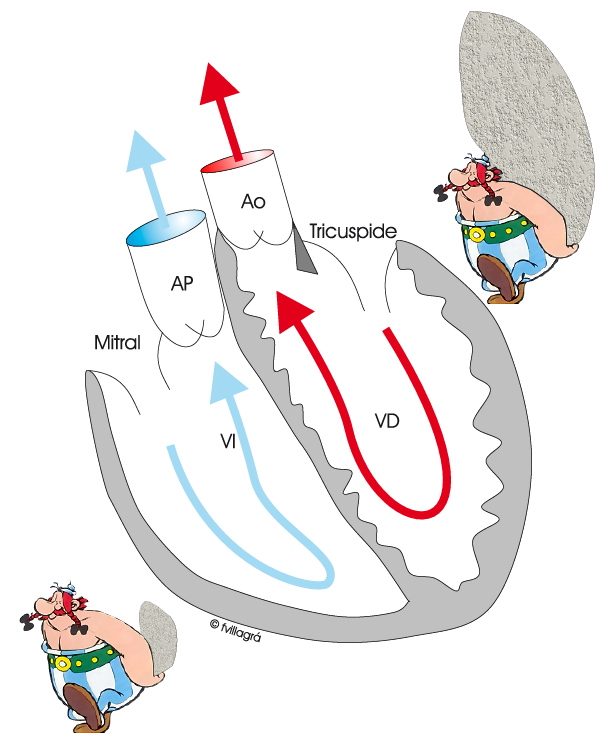
En la figura inferior izquierda se puede observar un dibujo de la transposición congénitamente corregida en la que los ventrículos están cambiados por error y cuya función y trabajo está simbolizado por un Obelix. El ventrículo izquierdo (VI) y la válvula mitral están anatómicamente preparados para desarrollar un intenso trabajo, el correspondiente a «lanzar» sangre (roja), con fuerza a todo el cuerpo. Sin embargo, en la L-TGA sólo tienen que «lanzar» la sangre (azul) no oxigenada a los pulmones, que sólo requiere un pequeño esfuerzo, de intensidad 6 veces menor que el que se requiere para llevar la sangre a todo el cuerpo. Es como si un «Obelix gigante» tuviera que acarrear una piedra muy pequeña (Ver dibujo inferior derecho). Esta situación no constituye un problema en estos pacientes, aparte del desperdicio de energía del VI, de la válvula mitral y del «Obelix gigante».
Por otra parte, el ventrículo derecho (VD) y la válvula tricúspide están preparados sólo para un trabajo poco intenso, el correspondiente a «lanzar» sangre (azul), no oxigenada a los pulmones. Sin embargo, en la L-TGA tienen que «lanzar» la sangre (roja), oxigenada a todo el cuerpo, lo que requiere un gran esfuerzo, de intensidad 6 veces mayor que el que se requiere para llevar la sangre a los pulmones. Es como si un «Obelix enano» tuviera que acarrear una piedra muy grande (Ver figura inferior derecha). Esta situación sí constituye un problema en estos pacientes. Con el tiempo pueden fracasar el ventrículo derecho y la válvula tricúspide y el niño entra en situación de insuficiencia cardiaca.
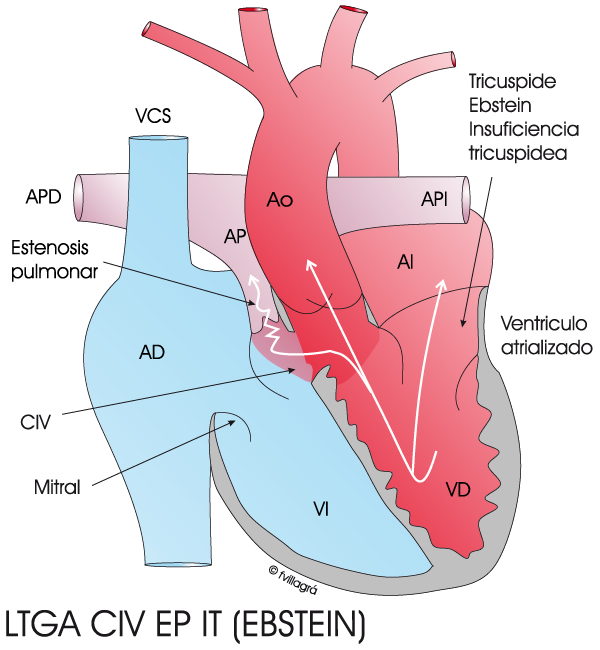
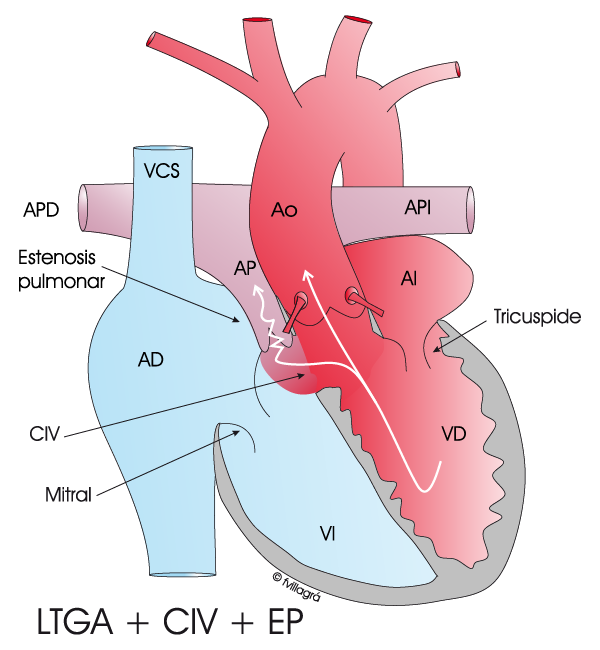
En los casos excepcionales en los que no hay lesiones asociadas, estos enfermos no precisan ninguna actuación quirúrgica, salvo que haya signos o síntomas de insuficiencia cardiaca incipiente. Sin embargo, en la casi totalidad de los casos se asocian otras anomalías que empeoran la situación cardiaca. Estas anomalías son: Ebstein (afecta a la válvula tricúspide, causando insuficiencia tricuspidea –IT-), comunicación interventricular o CIV, estenosis pulmonar o EP, ambas (CIV EP) y bloqueo congénito auriculoventricular, que se manifiesta al nacer o a lo largo de los años de evolución.
Hay 2 tipos básicos de operaciones para la TGACC:
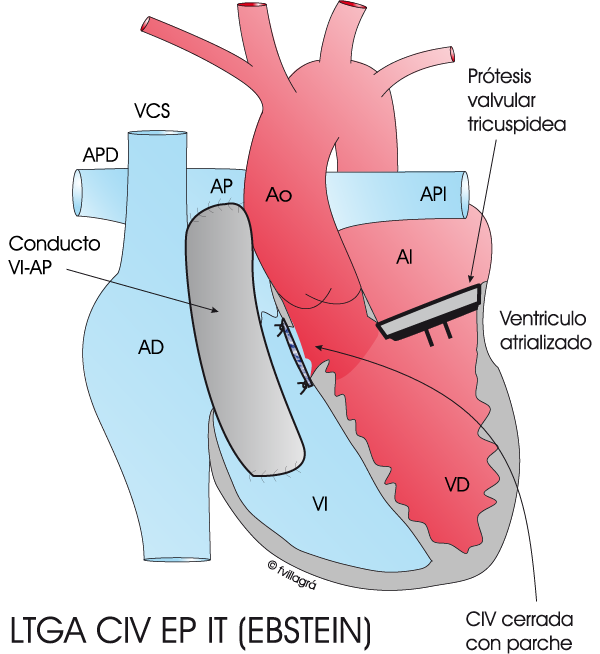
1) La clásica, la más antigua, la fisiológica que consiste en corregir las diferentes anomalías asociadas implantado una prótesis valvular en posición tricuspídea si hay un Ebstein, cerrando la CIV con un parche o conectando el VI con la AP con un conducto valvulado o avalvulado, para sobrepasar una EP (Figura inferior); no cambia los ventrículos, que siguen conectados a las circulaciones que no les corresponden (el VD sigue con la sangre (roja) que envía a todo el cuerpo y el VI con la (azul) que envía a los pulmones).
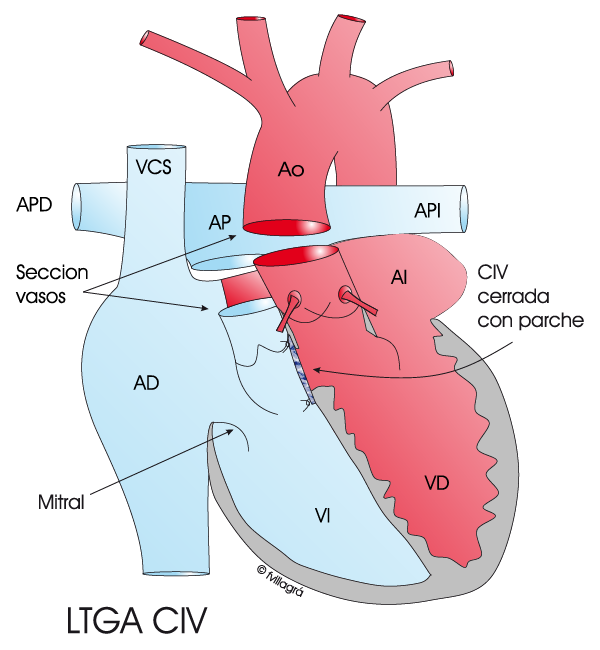
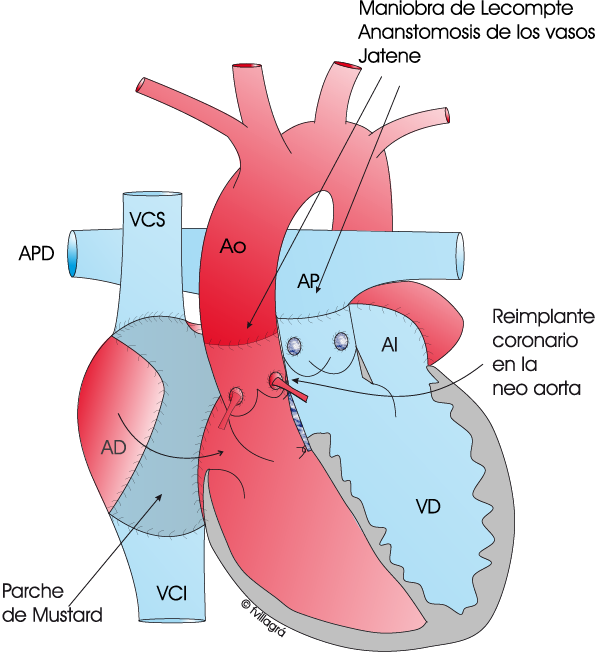
2) La más moderna, la anatómica, que consiste en emplazar a los dos ventrículos y las válvulas mitral y tricúspide en sus circulaciones habituales (el VD y tricúspide «lanza» sangre (azul) a los pulmones y el VI y mitral “lanza” sangre (roja) a todo el cuerpo), al mismo tiempo que corrige las anomalías asociadas como la CIV y CIV+EP. La corrección anatómica implica «cruzar» las sangres dos veces (doble «switch«): Una a nivel auricular (Técnica de Mustard o Senning) mediante la cual la sangre (roja) que proviene de las venas pulmonares pasa a la mitral y VI y la sangre (azul) de las venas cavas (VC) pasa a la tricúspide y VD; y otra a nivel de la conexión ventriculoarterial.
La conexión ventriculoarterial se puede realizar de dos maneras dependiendo de la anatomía:
1) Técnica de Jatene si solo hay CIV
El dibujo inferior izquierdo muestra la anatomía de una TGACC + CIV. En las figuras inferiores central y derecha se puede observar la reparación quirúrgica del doble switch: Mustard y técnica de Jatene y simultaneamente cierre de la CIV con parche.
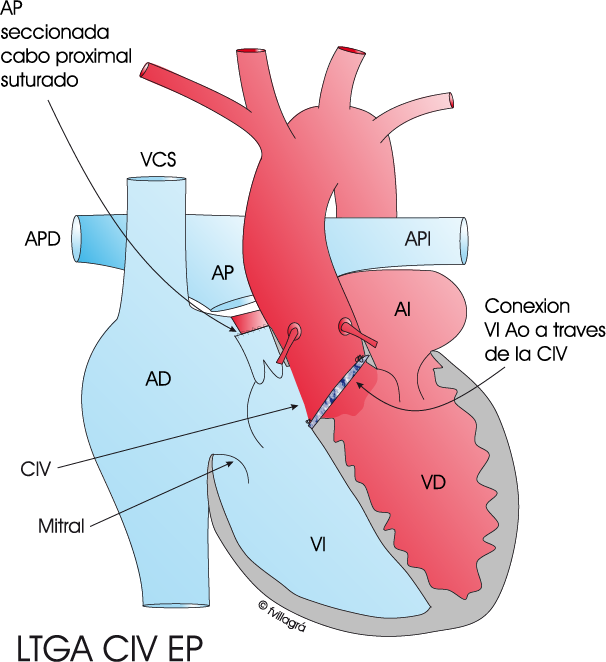
2) Técnica de Rastelli si hay CIV EP
El dibujo inferior izquierdo muestra la anatomía de la TGACC+CIV+EP. Las figuras inferiores central y derecha muestran una reparación quirúrgica anatómica (Mustard y conexión VI-Ao y VD-AP), la primera a través de la propia CIV y la segunda mediante un conducto extracardiaco entre VD y arteria pulmonar (Técnica de Rastelli). Con ambas conexiones, la auricular y la ventriculo-arterial, la sangre (roja) del VI pasa a la aorta y la (azul) del VD pase a la arteria pulmonar. Gracias a esta corrección, la sangre (roja) y (azul) van donde tienen que ir y además los ventrículos están conectados a sus circulaciones habituales.
No es infrecuente que la LTGA se asocie a una insuficiencia severa (Ebstein) de la válvula tricúspide (IT). En estos casos no se actúa sobre estas estructuras en la corrección anatómica, con la esperanza fundada de que la función tricuspídea mejore, al conectar la válvula tricúspide a la circulación pulmonar reduciendo su trabajo a la sexta parte del que tenía antes de operarse.
Sin embargo, no todo es prometedor en la corrección anatómica: es una técnica compleja, muy laboriosa, conlleva múltiples suturas y parches que pueden resultar en arritmias (el Mustard y Senning son técnicas muy antiguas que antes se realizaban en la transposición de grandes arterias o TGA y causaban arritmias en un buen número de casos), obstrucciones, etc. No es claro todavía que la corrección anatómica supere en resultados a la fisiológica.
La mitad de los pacientes con LTGA han presentado o presentarán en el futuro un bloqueo auriculoventricular completo que requiere el implante de un marcapaso definitivo tipo VDD o DDD, de forma aislada o en combinación con la corrección fisiológica o anatómica.
Indicaciones terapéuticas actuales en los diferentes tipos de TGACC
La que a continuación expongo puede constituir una guía general de indicaciones quirúrgicas en la LTGA (está basado en la experiencia del grupo quirúrgico de Cleveland):
TGACC con CIV e hiperaflujo pulmonar
Esta situación cursa con muchos síntomas en los primeros meses de vida y requiere actuación quirúrgica inmediata o muy precoz. En estos casos hay que hacer:
- Corrección anatómica (Jatene + Mustard/Senning) dentro de los 3 meses de edad.
- Excepcionalmente, cerclaje de la arteria pulmonar (es una primera operación más sencilla pero paliativa) en casos especiales en los que la aurícula y el apex cardiaco están en el mismo lado (dextrocardia) u otros. Cuando el niño tenga más del año de edad, se puede llevar a cabo la corrección anatómica con el doble switch (segunda operación)
TGACC sin CIV (o CIV restrictiva) y sin EP (o EP leve)
A) Si el niño tiene insuficiencia tricúspide severa y/o Ebstein severo, requiere una cirugía también muy precoz, pues cursa con una insuficiencia cardiaca severa y síntomas. Consiste en:
Doble switch siempre que el ventrículo morfológicamente izquierdo pero que envía sangre a los pulmones, esté suficientemente preparado para soportar el tener que lanzar la sangre no a los pulmones (cuesta poco) sino a todo el cuerpo (cuesta 6 veces más). Algunos ventrículos se han hecho “perezosos” al tener que trabajar poco (lanzar sangre a los pulmones cuesta poco) y necesitan un entrenamiento para hacerse más fuertes. Lo consiguen con el cerclaje de la arteria pulmonar mantenido durante 6-12 meses. Para saber si un ventrículo izquierdo está o no preparado para lanzar sangre a todo el cuerpo hay que saber la presión sistólica que genera. Si esta es >70% de la presión arterial, quiere decir que el ventrículo izquierdo está preparado y se puede llevar a cabo directamente el doble switch.
Si el ventrículo izquierdo tuviera la presión < 70% de la sistémica, es mejor hacer un cerclaje de la arteria pulmonar y esperar al menos 6-12 meses para llevar a cabo en una segunda operación el doble switch. Con el cerclaje suele disminuir la insuficiencia tricúspide y mejorar importantemente la situación clínica. Si estuviera en las anteriores circunstancias (escasa preparación del ventrículo izquierdo) y además la situación clínica del paciente fuese muy grave, se puede abordar el doble switch, pero con el apoyo de la asistencia mecánica circulatoria o ECMO postoperatorio.
B) Si la insuficiencia tricuspídea es leve-moderada y/o el paciente tiene bloqueo av:
Es mejor realizar cerclaje de la arteria pulmonar y esperar al menos 6-12 meses para realizar el doble switch
C) Si no tiene insuficiencia tricuspídea, ni disfunción del ventrículo derecho ni insuficiencia cardiaca, ni bloqueo av:
La mayoría de los cirujanos prefieren en estos casos no hacer nada; sencillamente, no operar y que el niño siga siendo visto por un cardiólogo para ver evolución. Algún cirujano opina que se puede hacer cerclaje profiláctico, para evitar la insuficiencia tricúspide y preparar algo el ventrículo izquierdo para que en el futuro pueda lanzar la sangre a todo el cuerpo.
TGACC con EP
A) EP moderada-severa con cianosis importante
En estos casos se debe hacer una fístula sistémico-pulmonar en una primera operación. Cuando el niño tenga >18 meses se puede llevar a cabo una segunda operación consistente en una Operación de Rastelli o Nikaidoh asociada a la técnica de Mustard/Senning. Si esto no fuera posible, se haría una operación de Glenn y Fontan como en un ventrículo único
B) EP leve con circulación balanceada y flujo pulmonar <2 veces el sistémico
En estos casos, todos los cirujanos recomendamos no hacer nada y que el cardiólogo siga viendo en consulta a este paciente para ver evolución, vigilando la aparición de la insuficiencia tricúspide y/o la disfunción del ventrículo derecho.