Los dispositivos mecánicos de asistencia circulatoria se emplean para suplir la función del corazón, en casos de insuficiencia cardiaca severa refractaria al tratamiento médico.
¿Qué es la asistencia circulatoria?
Es un dispositivo mecánico cuya función es ayudar al corazón en situaciones críticas. Se trata de una bomba cardiaca mecánica que lanza con fuerza la sangre a todo el cuerpo (sustituye o ayuda al corazón enfermo en su función de bombeo), de forma que todos los órganos estén bien perfundidos. Este sistema de bombeo puede tener acoplado un oxigenador en los casos en que la función del pulmón y la oxigenación estén también comprometidas. Los sistemas de asistencia circulatoria están diseñados para mantener una asistencia circulatoria de diferente duración: días (asistencias de corto plazo) o meses (asistencias de larga duración).
Tipos de Asistencia Circulatoria Mecánica:
- Asistencias de corto plazo: se usan en situaciones agudas y urgentes, en las que el deterioro del paciente es rápido. Su duración es de días/semanas.
-
-
-
- ECMO (ExtraCorporeal Membrane Oxygenation). Ver ECMO.
- Centrimag/Pedimag (Levitronix). En la práctica es parecido al ECMO. Se compone de una bomba centrífuga de levitación magnética (suple la acción del corazón). No obstante, se le puede intercalar un oxigenador en pacientes que tengan deterioro de la función pulmonar.
- VAD (Ventricular Assist Device). De corta duración, se usa en situaciones especiales como coronaria anómala naciendo de la arteria pulmonar. No tiene oxigenador.
- Balón de contrapulsación. Tal como se puede observar en la figura superior, consiste en un balón que se inserta a través de la arteria femoral en la aorta y se infla y desinfla acoplado al latido cardiaco, para favorecer la eyección de sangre del ventrículo izquierdo, la perfusión coronaria y la distribución de la sangre a todos los demás órganos. Proporciona una ayuda reducida de bombeo al corazón. Se limita a ayudar, nunca a sustituir al corazón. Este es el dispositivo de asistencia ventricular más empleado actualmente en adultos, pero tiene grandes limitaciones en niños y prácticamente no se utiliza.
-
-
-
- Asistencias de largo plazo (Son todos de tipo VAD, sin oxigenador): se implantan en pacientes más estables, en situaciones electivas (no de urgencia). La función pulmonar debe estar preservada, ya que son dispositivos que bombean la sangre, pero no la oxigenan. Su duración es de meses.
-
-
-
- Berlin Heart (EXCOR®): es un dispositivo paracorpóreo (la bomba está fuera del paciente) que se conecta a éste por cánulas que van y vienen del corazón del paciente. La bomba hace las veces de ventrículo y proporciona un flujo pulsátil mediante una fuente de energía pneumática (aire). Puede ser univentricular (si asiste al ventrículo izdo) o biventricular (si asiste a ambos ventrículos) en función de las necesidades del paciente. Es el dispositivo más empleado en niños; se puede utilizar en todo rango de edad, desde recién nacidos hasta adultos, porque dispone de distintos tamaños de bomba en función del peso del paciente. Ver Berlin Heart.
-
-
-
- Heart Ware (Ver figura inferior): es un dispositivo intracorpóreo (la bomba se implanta dentro del paciente) de flujo continuo de tipo axial (el motor es una especie de hélice que impulsa la sangre). Cada vez se está implantando más en niños mayores y adolescentes, ya que permite dar de alta al paciente a casa hasta el trasplante.
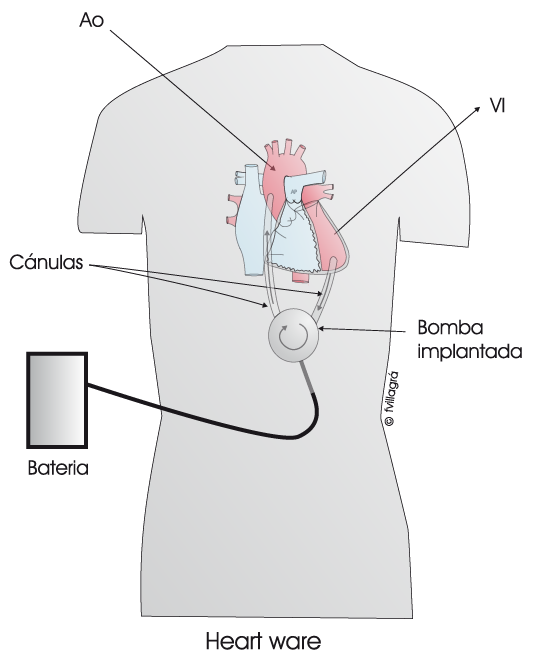
-
-
-
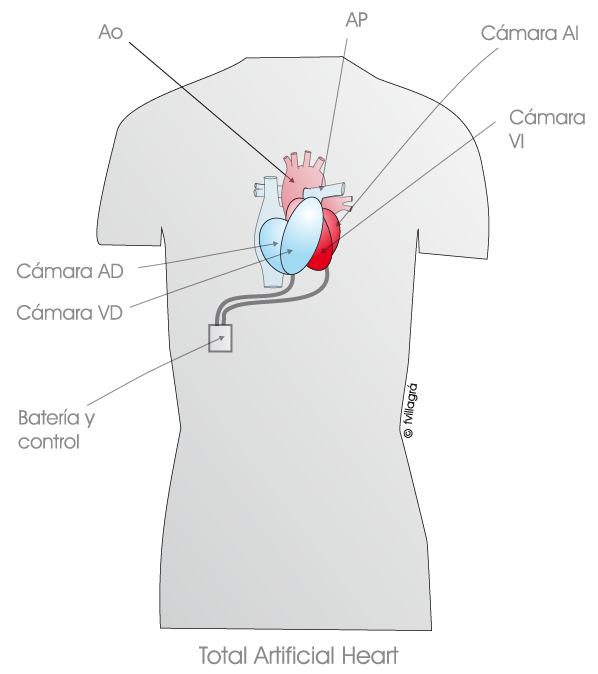
- Total Artificial Heart (Syncardia) (ver figura inferior): es un dispositivo intracorpóreo que sustituye completamente al corazón. Para su colocación es preciso resecar los ventrículos del corazón del paciente. Tiene una bomba derecha que se conecta a la aurícula derecha y a la arteria pulmonar del paciente, y una bomba izquierda que se conecta con la aurícula izquierda y la aorta del paciente. Se han implantado principalmente en adultos (unos 1.700) y en niños con superficie corporal mayor de 1,7 m2. Podría considerarse en un futuro en pacientes mayores de 10 años con disfunción biventricular como puente al trasplante o como terapia definitiva.
-
-
¿Cuáles son las causas más frecuentes del implante de una asistencia circulatoria?
-
-
- Hipoxemia severa preoperatoria: Hay pacientes portadores de cardiopatías congénitas con escaso flujo hacia los pulmones (ejemplo: tetralogía de Fallot) que pueden ingresar en el hospital de urgencia en una situación de cianosis crítica con niveles muy bajos de oxígeno en sangre (hipoxemia). Estos pacientes, debido a su mal estado clínico, no pueden tolerar una cirugía inmediata para reparar su cardiopatía. En este estado de extrema gravedad, se puede colocar una asistencia circulatoria de corta duración con oxigenador (ECMO) para mejorar su situación clínica y, posteriormente, someterles a la cirugía cardiaca. También es suceptible de asistencia circulatoria la hipoxemia por hipertensión pulmonar neonatal.
- Miocarditis aguda: inflamación del miocardio producida por virus que produce alteración de la contractilidad. Produce insuficiencia cardiaca aguda. Ver miocarditis.
- Miocardiopatías: alteración de la función de los ventrículos secundaria a daño directo en el músculo cardiaco. Ver miocardiopatías:
- Cardiopatís congénitas:
- en una fase final acompañada de insuficiencia cardiaca crónica, o
- tras una cirugía cardiaca; en este caso la insuficiencia cardiaca es aguda.
-
Los pacientes con cardiopatías congénitas recién operados necesitan tratamiento en una unidad de cuidados intensivos para superar el postoperatorio y cualquier situación de deterioro de la función cardiaca. Ver intensivos. Este tratamiento consiste en el uso de múltiples drogas de acción cardiaca, vascular, renal y sobre otros órganos, así como administración de productos hemáticos (sangre, plasma y plaquetas). Estos pacientes pueden además requerir técnicas sofisticadas para garantizar la eliminación de orina (diálisis peritoneal, hemofiltración…). Con este tratamiento sale adelante la inmensa mayoría de los pacientes. Cuando el deterioro de la función cardiaca es tan severo que ni siquiera la aplicación de todos estos medios es suficiente, recurrimos a la asistencia circulatoria mecánica.
¿En qué momento de la evolución clínica se debe iniciar la asistencia circulatoria?
Debemos implantar una asistencia circulatoria en pacientes con cardiopatía que, pese a recibir un tratamiento médico optimizado, presenten:
- Signos de bajo gasto cardiaco. (insuficiente aporte de oxígeno a los tejidos por fallo de la bomba cardiaca): mal color y aspecto (ver foto superior), alteraciones en la analítica (aumento del ácido láctico en sangre…), disminución de la orina del paciente…
- Necesidad de soporte respiratorio con ventilación mecánica en aumento.
- Alteración importante de la contractilidad en el ecocardiograma que precisa altas dosis de fármacos intravenosos de acción cardiaca.
Clasificación de la asistencia circulatoria de acuerdo a la finalidad de su instauración
La instauración de la asistencia circulatoria tiene diferentes objetivos y, de acuerdo a ellos, se elige un tipo u otro de asistencia circulatoria.
- Como puente a la decisión: Se pueden implantar asistencias circulatorias de corto plazo en pacientes con shock cardiogénico refractario al tratamiento con drogas cardiovasculares, para mantener al paciente con vida hasta conseguir una evaluación clínica completa que permita la toma de decisiones terapéuticas definitivas.
- Como puente a la recuperación: En pacientes con insuficiencia cardiaca refractaria al tratamiento médico y de causa reversible, que precisan un “apoyo” temporal hasta que la función cardiaca se recupere por sí misma, se puede implantar una asistencia circulatoria de corto plazo (principalmente ECMO). Si se produce finalmente la recuperación, se retira el dispositivo. Tres son las situaciones habituales de este grupo:
- Paciente recién operado de una cirugía cardiaca (postcardiotomía): Con el ECMO se logra una supervivencia del 55-60%, pero el 10% de los casos requiere finalmente trasplante cardiaco para sobrevivir, al no recuperarse el corazón con el ECMO. Si el ECMO no va bien en aproximadamente 15 días se aconseja pasar a Berlin Heart como puente al trasplante.
- En la miocarditits aguda con fallo miocárdico.
- Post-parada cardiaca (en resucitación): Se lleva a cabo en pacientes hospitalizados que sufren una parada cardiaca brusca que no responde a las maniobras de resucitación durante 20-30 minutos.
- Como puente al trasplante. Se pueden implantar asistencias de larga duración (tipo VAD como el Berlin Heart) en pacientes en situación de insuficiencia cardiaca refractaria al resto de medidas, en los que suponemos que el corazón no se va a recuperar y que precisan un trasplante de manera urgente o a corto plazo, como tratamiento temporal hasta que exista un donante disponible. La supervivencia en estos casos es de en torno al 60%. En España, de los 7.576 trasplantes cardiacos contabilizados hasta el 2015 (incluye pacientes adultos), el 3,7% llegan con algún tipo de asistencia circulatoria de larga duración tipo VAD, el 2,5% llegan con ECMO al trasplante y el 2,6 % llegan con balón de contrapulsación.
- Como puente a la candidatura (ser candidato a trasplante): En pacientes en situación de insuficiencia cardiaca e indicación de trasplante, salvo por la presencia de hipertensión pulmonar severa o insuficiencia de otros órganos (hepática, renal, encefalopatía…). La asistencia ventricular podría mejorar la hipertensión pulmonar o revertir la situación de insuficiencia de los otros órganos, consiguiendo así el paciente cumplir criterios para ser candidato a trasplante.
- Como terapia definitiva o de destino: Se puede implantar una asistencia de larga duración en pacientes sintomáticos con insuficiencia cardiaca crónica a pesar de tratamiento convencional óptimo, que hayan sido rechazados para trasplante cardiaco, en los que se suponga una supervivencia estimada >1 año con buen estatus funcional si se implanta la asistencia. Esta indicación no está establecida en niños, sí en adultos. Se ha colocado una asistencia para este propósito de manera excepcional en algunos pacientes pediátricos con enfermedades neurológicas graves que cursan con debilidad muscular y alteración de la contractilidad del corazón.
Complicaciones de las asistencias circulatorias.
Colocar una asistencia ventricular no está exenta de riesgos; por ello, antes de su implante se debe hacer un balance de la relación beneficio/riesgo para asegurarnos de que ésta sea favorable. El principal inconveniente de estos pacientes es la necesidad de mantener la sangre anticoagulada (más líquida de lo normal) para evitar la formación de trombos (agregados de sangre) dentro de los dispositivos/cánulas que obstruyan la circulación de la misma. En la población pediátrica el manejo de la anticoagulación es más complejo que en la edad adulta y es de la que derivan los problemas principales.
Dentro de las complicaciones, estas son las más relevantes:
- Hemorragias: los pacientes portadores de asistencias ventriculares deben estar anticoagulados y esto predispone al sangrado.
- Trombosis: las asistencias ventriculares son dispositivos trombogénicos (predisponen a la formación de trombos), por ello precisan de anticoagulación.
- Complicaciones neurológicas (hemorragia intracraneal e infartos isquémicos): representa una de las causas más importantes de morbilidad y mortalidad en los pacientes con asistencias ventriculares, y es debida a problemas tromboembólicos y hemorrágicos.
- Infecciones: las infecciones cutáneas en el lugar de implante de las cánulas, la sepsis y las infecciones pulmonares son relativamente frecuentes en este grupo de pacientes. Los procesos infecciosos, a su vez, pueden alterar los parámetros de la coagulación produciendo desajustes en la misma.
