Estudios citogenéticos o cromosómicos.
Los últimos años han sido realmente emocionantes porque han permitido un gran avance en el diagnóstico de enfermedades de origen genético. De hecho, estos avances han puesto de manifiesto que la genética juega un papel mucho más importante como causa de las cardiopatías congénitas que lo que hasta ahora habíamos considerado. Las malformaciones cardiacas al nacimiento constituyen un porcentaje mayoritario de los defectos congénitos. El diagnóstico preciso y las posibles terapias indican que cada vez hay más personas con cardiopatías congénitas que llegan a la edad adulta y tienen la oportunidad de reproducirse. El diagnóstico genético preciso asociado a las cardiopatías congénitas es extraordinariamente importante, porque nos permite identificar si puede haber otros órganos involucrados, realizar un posible pronóstico clínico, realizar un cálculo de riesgo familiar que permite determinar futuros riesgos reproductivos e identificar otros familiares con riesgo de sufrir la enfermedad.
Clásicamente, los estudios citogenéticos han permitido identificar individuos con anomalías cromosómicas y anomalías congénitas, incluidas las cardiopatías. Mediante estas técnicas es posible diagnosticar trisomías en las que hay un cromosoma extra, como el síndrome de Down o trisomía 21, o la trisomía 18 o síndrome de Edwards, donde el 100% de los pacientes presentan anomalías cardiacas. Por tanto, los análisis cromosómicos siguen siendo importantes en el diagnóstico de pacientes con anomalías cardiacas congénitas, especialmente si presentan rasgos dismórficos u otras anomalías. Según el nivel de resolución conseguido, estos estudios nos permiten identificar reordenamientos cromosómicos, tales como deleciones, duplicaciones, translocaciones…que son alteraciones más pequeñas que afectan a pequeñas regiones cromosómicas. El tiempo medio de estos estudios varía según el laboratorio, pero puede oscilar entre 10-30 días. La unión de técnicas citogenéticas y de biología molecular nos ha permitido estudiar los cromosomas a un nivel de resolución muchísimo mayor. Entre ellas, la hibridación in situ fluorescente es capaz de identificar posibles trisomías, en especial aquellas más frecuentes como la 13, 18 y 21, en un tiempo récord de 24-48 horas al no necesitar del cultivo de la muestra.
Actualmente es posible el diagnóstico precoz en la semana 20 de gestación de muchas de las anomalías cardiacas fetales. El diagnóstico prenatal citogenético es posible mediante el cultivo de células de líquido amniótico, biopsia de vellosidades coriales o extracción de una pequeña cantidad de sangre fetal mediante cordocentesis. El diagnóstico genético en estos casos es esencial, permitiendo realizar un posible pronóstico vital o terapéutico fetal. Identificar fetos con anomalías cromosómicas posibilita una información precisa a los padres, informando de un pronóstico fetal, posibles tratamientos o la esperanza de vida.
Un tipo de diagnóstico prenatal muy precoz es el diagnóstico genético preimplantatorio. Mediante técnicas de fertilización in vitro es posible conseguir embriones en el laboratorio. Estos embriones pueden estudiarse para descartar posibles anomalías cromosómicas o enfermedades de origen genético, siempre que se conozca el error genético en la familia. En el caso que el embrión sea sano es posible la transferencia, mientras que si el embrión es portador de alguna anomalía genética es descartado. Este tipo de técnica solo es posible en familias de riesgo de algún tipo de enfermedad genética familiar, y cuando es factible el análisis genético en una única célula.
Sin embargo, el poder de resolución de estas técnicas citogenéticas es muy limitado. Actualmente, nuevas técnicas han permitido identificar nuevas alteraciones genéticas asociadas a las cardiopatías congénitas.
Estudios moleculares
Como hemos mencionado, los estudios citogenéticos proporcionan información de la constitución cromosómica del individuo. Sin embargo, hoy sabemos que muchas de las enfermedades son debidas a cambios más finos, localizados en la secuencia del ADN, y que no es posible identificar con estos estudios. El proyecto genoma humano nos ha suministrado una gran cantidad de información de las secuencias de los genes en el hombre. Sabemos que todas las células tienen la misma información genética. ¿Por qué las células del riñón son diferentes de las del pulmón, del corazón o del hígado, si todas tienen los mismos genes? Los genes son estructuras complejas que presentan tanto las secuencias codificantes, es decir, aquellas que se traducirán en la secuencia de aminoácidos de las proteínas, como las secuencias reguladoras. Y son estas secuencias reguladoras las que permiten que determinados genes se expresen en determinados momentos del desarrollo o en determinados tipos celulares. Así, las células del corazón expresan genes específicos del corazón y no expresan genes específicos del hígado, aun cuando tanto unas como otras llevan los mismos genes. El proyecto genoma humano nos ha permitido identificar las secuencias codificantes y las secuencias reguladores de la actividad de los genes.
El análisis de las secuencias de los genes permite identificar pequeños cambios en la secuencia de ADN, incluso de una única base (ATGC), que altere la secuencia de aminoácidos y, por tanto, la función de la proteína. Sin embargo, una vez identificado un cambio en la secuencia es importante determinar si realmente ese cambio es patológico. Para ello hay que determinar si altera la función o expresión de la proteína, está presente en otros familiares con la enfermedad y no está presente en la población normal.
Sin embargo, poco se sabe de los genes involucrados en el desarrollo y función del desarrollo cardiaco. Actualmente existe una gran heterogeneidad, con diferentes tipos de mutaciones que afectan de forma diferente a la función de la proteína, incluyendo pérdida de expresión, inactivación de la proteína, pérdida de función o la adquisición de una nueva función diferente a la que tenía. La oportunidad de identificar las causas genéticas nos permitirán definir la patogénesis de los cambios genéticos y poder desarrollar nuevas estrategias diagnósticas y terapéuticas como alternativa a las que actualmente utilizamos.
Síndrome de microdeleción 22q11.2 / síndrome de DiGeorge.
El síndrome de DiGeorge se caracteriza por unos rasgos faciales específicos, aplasia o hipoplasia de timo, aplasia o hipoplasia de las glándulas paratiroideas y malformaciones cardiacas. Un porcentaje muy elevado de pacientes con síndrome de DiGeorge presenta una microdeleción de la región 22q11.2. Sin embargo, pacientes con características clínicas similares presentan deleción del brazo corto del cromosoma 10, o son debidas a diabetes mellitus materna o consumo de alcohol materno, demostrando causas heterogéneas del cuadro clínico.
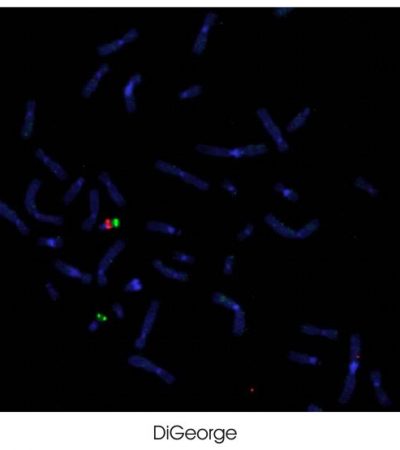
En la imagen se observa un estudio mediante hibridación in situ fluorescente. Los cromosomas son teñidos con una contratinción, DAPI, que los tiñe de azul. La señal verde se corresponde con una localización específica del cromosoma 22 y se utiliza como control. La señal roja se corresponde con el gen HIRA. Puede observarse que hay un cromosoma 22 con una señal verde y otra roja. es un cromosoma normal. El otro cromosoma solo presenta dos puntitos de color verde (en realidad es un solo punto verde) careciendo de la señal roja que corresponde al gen HIRA, que está ausente, lo que implica la existencia de deleción 22q11.2 o ausencia del gen HIRA. Es el cromosoma patológico.El cuadro clínico, fenotipo, de la deleción 22q11.2, es altamente heterogéneo, incluso dentro de la misma familia. Así encontramos neonatos con un cuadro clínico severo, donde uno de los progenitores es portador de la misma deleción y que presenta fenotipo prácticamente asintomático. Por tanto en pacientes con deleción 22q11.2 es importante el estudio familiar, que nos permita identificar una posible anomalía familiar. En la situación en la que uno de los padres sea portador de la misma deleción, permite no solo un seguimiento de él, sino que nos permite un consejo genético, proporcionando información importante para la familia. En estos casos es posible la realización de un diagnóstico prenatal, aunque no es posible predecir la severidad del fenotipo, o un diagnóstico preimplantatorio. Las anomalías cardiacas más frecuentes asociadas a la microdeleción 22q11.2 incluyen tetralogía de Fallot, interrupción del arco aórtico, truncus arteriosus, defecto del septo ventricular cono ventricular y anomalías del arco aórtico. La estenosis pulmonar, defectos del septo auricular y síndrome del corazón hipoplásico izquierdoson otras anomalías observadas en pacientes con este síndrome. Diagnosticar la anomalía genética en estos pacientes con anomalías cardiacas es fundamental para evaluar posibles anomalías adicionales a este síndrome. Estos pacientes pueden presentar, entre otras características, una predisposición a infecciones que ha de tenerse muy en cuenta ante posibles terapias correctivas.
Síndrome de Williams-Beuren
El síndrome de Williams-Beuren es una enfermedad autosómica dominante caracterizada por la deleción de 1,5-1,8 millones de bases de la región 7q11.23. Los pacientes con este síndrome presentan anomalías cardiovasculares, hipercalcemia infantil, anomalías esqueléticas y renales, déficit cognitivo y una personalidad característica. Dado que el tamaño de la deleción afecta a múltiples genes, este síndrome se engloba dentro de los síndromes de deleción de genes contiguos. Así, la deleción o alteración de genes específicos en esta región se corresponde con características clínicas específicas. Los pacientes presentan una alta variabilidad clínica, de modo que la deleción de diferentes genes da lugar a diferentes manifestaciones clínicas. Por ejemplo, la deleción del gen de la elastina, ELN, se corresponde con el desarrollo de las manifestaciones vasculares de la enfermedad, mientras que grandes deleciones, donde hay pérdida de múltiples genes, se asocian con un fenotipo severo.
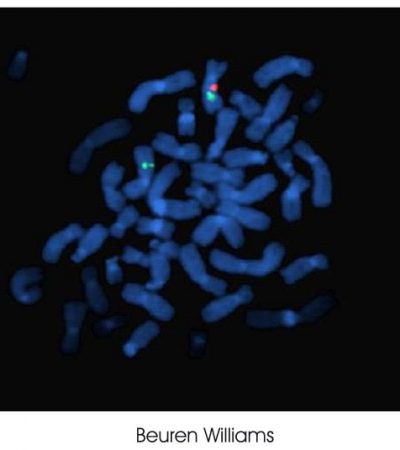
En la imagen observamos mediante hibridación in situ fluorescente el gen ELN, involucrado en el síndrome de Williams-Beuren. En el cromosoma normal 7 se puede observar la señal control en verde y la correspondiente al gen ELN en rojo. Es el cromosoma normal. El cromosoma con la deleción presenta la señal control verde, y ausencia de la señal roja correspondiente al gen ELN. Es el cromosoma patológico.Dado que los pacientes con este síndrome presentan una variabilidad clínica, la estenosis supravalvular aórtica o la estenosis pulmonar es una clara sospecha de microdeleción 7q11.2.
Enfermedades monogénicas
En los últimos años, y como consecuencia del gran avance en el conocimiento del genoma humano, se han identificado las causas genéticas moleculares de una serie de anomalías cardiacas. En cualquier caso, es previsible que en un futuro cercano conozcamos nuevas mutaciones y nuevos genes involucrados en estas patologías. Una de las tareas pendientes es la transferencia del conocimiento desde la investigación básica a la práctica clínica.
Recientemente se han identificado los genes responsables de varios síndromes que presentan anomalías cardiacas congénitas asociadas a otras anomalías fenotípicas.
Síndrome de Alagille
Es un síndrome autosómico dominante que afecta a múltiples órganos, principalmente al hígado, corazón, ojos, cara y esqueleto. Sin embargo, las características clínicas son muy variables, incluso entre miembros de la misma familia.
Entre el 3-7% de los pacientes presenta una deleción en 20p12 que puede ser visible mediante estudios citogenéticos. Se han identificado mutaciones en el gen JAG1 asociadas con una amplia variabilidad clínica en el 89% de los pacientes con características clínicas de síndrome de Alagille. Un número muy reducido de pacientes, entre el 1-2%, presentan mutaciones en el gen NOTCH2.
La identificación de la anomalía genética en un paciente con síndrome de Alagille es crucial para poder identificar otros familiares asintomáticos y poder realizar un consejo genético y un cálculo del riesgo de recurrencia.
Síndrome de Noonan
El síndrome de Noonan, con un patrón de herencia autosómico dominante, se caracteriza por una facies típica, talla corta, anomalías cardiaca congénita y retraso del desarrollo en grado variable. La anomalía cardiaca congénita afecta al 50-80% de los pacientes, siendo la estenosis de la válvula pulmonar la anomalía más frecuente. La cardiomiopatía hipertrófica se detecta en el 20-30% de los pacientes al nacimiento o lo desarrollan durante la infancia.
Los pacientes con síndrome de Noonan presentan una dotación cromosómica normal. Se han identificado una serie de mutaciones en diferentes genes:
- PTPN11
- SOS1
- RAF1
- RIT1
Dado que se trata de una enfermedad dominante, hay un riesgo del 50% de que un paciente con síndrome de Noonan tenga un hijo/a con este síndrome.
Síndrome de Holt-Oram
El síndrome de Holt-Oram se caracteriza por malformación cardiaca congénita y malformaciones en las extremidades superiores, con mutaciones en el gen TBX5 en el 70% de los pacientes. Sin embargo, es previsible que el resto de los pacientes presenten mutaciones en las regiones reguladoras o deleciones/inserciones en este gen y que no son detectadas mediante las técnicas utilizadas normalmente. Se ha observado que una mutación en el extremo 5` del gen TBX5 se asocia con los defectos cardiacos más severos, mientras que las mutaciones en el extremo 3` se asocian con defectos severos en los miembros. Aun así, no es posible predecir un fenotipo basado en la identificación de una mutación en concreto.
Enfermedades monogénicas no sindrómicas
El proyecto genoma humano nos permite realizar un estudio masivo de mutaciones en genes en pacientes con anomalías cardiacas congénitas no sindrómicas. Sin embargo, aunque se han identificado mutaciones en genes en este tipo de pacientes, resulta muy difícil demostrar el significado funcional de las mutaciones. No solo hay que demostrar que la mutación identificada en un gen en particular es responsable de la anomalía, sino que no debe estar presente en la población normal. De tal modo que, una vez se identifica un cambio en un gen en un paciente con cardiopatía, hay que realizar un estudio poblacional para demostrar que realmente el cambio es patológico y no se trata de una variante normal en la población.
En niños con defectos del septo, sin otras anomalías, se han identificado cambios en la secuencia del ADN del gen GATA4. En el estudio de individuos control no se han identificado estos cambios, y por tanto se asume que son responsables de la patología. El siguiente paso consiste en la identificación de estas mutaciones u otras nuevas en el gen GATA4 en un mayor número de pacientes con defectos del septo u otros tipos de anomalías cardiacas esporádicas.
El estudio de un gran número de pacientes con anomalías cardiacas esporádicas permitirá identificar nuevas mutaciones en genes conocidos, como en TBX5 y GATA4, así como estudiar los procesos biológicos de esta patología, lo que repercutirá en posibles terapias.
Sin embargo, es previsible que la mayoría de los casos de anomalías cardiacas aisladas no sean debidos a anomalías de un único gen, sino más bien a la interacción de múltiples genes y de su relación con factores ambientales.
Hay evidencias de que existe una gran variabilidad clínica en pacientes con la misma anomalía, incluso entre miembros de la misma familia. Estas circunstancias nos hacen deducir que hay tanto factores genéticos como ambientales que modifican la expresión de ciertos genes. Esta variabilidad genética y clínica demuestra la complejidad de los estudios genéticos en pacientes con anomalías cardiacas aisladas.
En conclusión
Los avances tecnológicos y del conocimiento en genética han permitido la identificación de mutaciones en genes responsables de múltiples tipos de anomalías cardiacas. Estos estudios identifican a pacientes y familiares de riesgo, permitiendo realizar un seguimiento multidisciplinar de pacientes de riesgo. Por otra parte, una vez hemos realizado un diagnóstico genético, podemos ofrecer un consejo genético / reproductivo a las familias.
Es previsible que los estudios genéticos masivos de pacientes con anomalías cardiacas nos permitan identificar nuevas mutaciones en genes conocidos en este tipo de patologías, como la identificación de mutaciones en genes hasta ahora desconocidos involucrados en los procesos de las anomalías cardiacas.
Por otra parte, la genética de las cardiopatías nos ayudará a comprender la formación, función de los diferentes genes y su interacción en las diferentes rutas metabólicas, lo que sin duda repercutirá en posibles tratamientos.